|
Résumé
Objectif : Comprendre les mécanismes pharmacologiques de l’interaction fluindione et phytothérapie.
Résumé du cas : Une femme, 55 ans, diététicienne, sans antécédents particuliers, sous fluindione 20 mg (3/4 comprimé par jour) pour une fibrillation auriculaire paroxystique, voit son INR déséquilibré (INR = 1,2) après ingestion de 2 gélules par jour d’extraits de soja.
Les autres facteurs connus pour diminuer l’INR sont éliminés. En accord avec le cardiologue, le traitement par Phytosoya® est conservé et la posologie de fluindione, adaptée (1 1/4 comprimé). L’INR retourne dans la fourchette thérapeutique au bout de 15 jours.
Discussion : Un seul cas d’interaction Phytosoya®/AVK, publié en 2002, décrit l’effet d’une consommation de lait de soja (protéines de soja) sur l’efficacité d’un traitement par warfarine. Les isoflavones, la génisteine et la daidzeine contenus dans les protéines de soja pourraient jouer un rôle dans la modification de l’absorption, du métabolisme et de l’excrétion biliaire de la fluindione en agissant sur des systèmes de transfert intestinaux et hépatiques impliquant la glycoprotéine P ou les polypeptides transporteurs d’anions organiques.
Conclusion : Lors d’une variation d’INR sous traitement anticoagulant, la question d’une consommation de soja et/ou de produits dérivés du soja devrait être envisagée. Une information aux praticiens et aux patients est nécessaire.
Mots-clés : fluindione, isoflavones, interaction, glycoproteine P, polypeptides transporteurs d’anions organiques.
Introduction
L’une des premières causes d’iatrogénie médicamenteuse conduisant à une hospitalisation est constituée par des accidents hémorragiques sous traitement par anti-vitamine K (AVK). Une des difficultés de la gestion des AVK réside dans de nombreuses interactions possibles, médicamenteuses ou mixtes, soit médicament et phytothérapie et/ou médicament et alimentation. Les auteurs présentent un cas décrivant l’effet d’un traitement de phytothérapie sur l’équilibre de l’INR d’une patiente traitée par fluindione, un anticoagulant oral disponible en France.
Présentation du cas
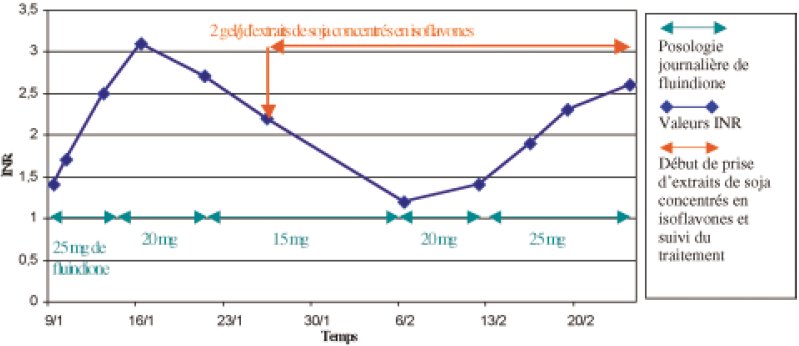
Une femme de 55 ans, diététicienne, sans antécédents particuliers, est hospitalisée le 6 janvier 2004 pour une fibrillation auriculaire paroxystique (FA). Cette hospitalisation dure trois jours pendant lesquels un traitement par héparinate de calcium (Calciparine®) en sous-cutanée à la dose de 500 UI/kg en 3 injections est instauré, suivi de fluindione 20 mg à la dose de 1 1/4 comprimé par jour le 9 janvier (INR = 1,4), jour de la sortie de cette patiente.
L’INR cible se situe entre 2 et 3 dans le cadre d’une FA. Un contrôle INR est effectué le lendemain, avec un résultat à 1,7, puis 3 jours après à 2,5. Le 16 janvier, l’INR est à 3,1 ce qui entraîne une adaptation posologique à 1 comprimé par jour de fluindione 20 mg. Un contrôle INR à 2,7 est réalisé le 21 janvier, entraînant une diminution de la dose à 3/4 de comprimé par jour. Le 26 janvier, l’INR est stabilisé à 2,2 sous 3/4 de comprimé par jour de fluindione 20 mg.
Lors des contrôles réguliers de suivi de traitement, un INR à 1,2 est détecté le 6 février. Cette diminution est à l’origine d’une augmentation de la posologie de fluindione 20 mg à 1 comprimé par jour. Une enquête sur les facteurs connus pour diminuer l’INR est alors envisagée. Après entretien avec la patiente, les principaux facteurs sont éliminés : observance jugée bonne, pas de nouvelle thérapeutique, pas d’augmentation de l’activité physique, pas de changement dans le mode de stockage de la fluindione, ni d’augmentation des apports alimentaires en vitamine K.
Cependant, lors de l’entretien, la patiente évoque la prise depuis près de cinq ans d’un traitement de phytothérapie (extraits de soja concentrés en isoflavones ou Phytosoya®) pour prévenir les bouffées de chaleur dues à la ménopause. La patiente a arrêté ce traitement d’elle même à l’entrée à l’hôpital mais l’a repris chez elle entre le 26 janvier et le 6 février.
En accord avec la patiente et son cardiologue, le traitement par Phytosoya® est conservé (effet bénéfique sur les symptômes de la ménopause) et associé à une adaptation posologique de la fluindione 20 mg (1 1/4 comprimé par
jour) afin de rééquilibrer son INR. La valeur d’INR revient dans la fourchette thérapeutique au bout de 15 jours, le 19 février (INR = 2,3) (Figure 1). Le traitement par fluindione 20 mg a été arrêté le 6 mars (durée totale du traitement : 2 mois).
Discussion
Ce cas clinique pose la question de l’impact de la prise d’isoflavones de soja sur des traitements anticoagulants. Afin d’essayer de comprendre le mécanisme pharmacologique de cette interaction, une revue de la littérature a été effectuée concernant les effets pharmacologiques et cliniques du soja et/ou de ses dérivés comme les isoflavones. Puis, dans un deuxième temps, les hypothèses pharmacologiques possibles sous-jacentes pour expliquer cette interaction ont été posées et seront présentées.
La spécialité Phytosoya® est fabriquée à partir de graines de soja. Cette graine est composée d’eau (8 %), de
métabolites primaires (glucides, lipides, protides) et de métabolites secondaires (caroténoïdes, flavonoïdes, isoflavones, stérols, triterpènes, vitamines B, E et D). Le Phytosoya® contient des extraits de soja concentrés en isoflavones - la génisteine et la daidzeine - soit 17,5 mg d’isoflavones par gélule. La posologie est de 2 gélules par jour, soit 35 mg d’isoflavones par jour. La posologie peut être portée à 4 gélules par jour en phase initiale, soit 70 mg d’isoflavones par jour.
Propriétés des isoflavones de soja
Action hormonale
Les études sur l’action potentielle hormonale du soja chez la femme post-ménopausée sont contradictoires. Les études à partir d’isoflavones portent, la plupart du temps, sur un nombre restreint de sujets, ce qui ne permet pas toujours d’analyse statistique. En ce qui concerne les femmes pré-ménopausées, les données publiées tendent à montrer que les phases du cycle menstruel ne sont pas significativement modifiées(1). Les résultats sont globalement en faveur d’une diminution de l’intensité et de la fréquence des bouffées de chaleur(2) (3). L’effet symptomatique est, cependant, parfois qualifié de modeste. Les isoflavones et leurs métabolites intestinaux (principalement l’équolcutérolactone) se fixent sur les récepteurs aux oestrogènes et développent, le plus souvent, une activité oestrogénique faible.
Dans la plupart des études concernant la diminution des bouffées de chaleur, la posologie d’isoflavones était de 50 mg par jour. Cependant, aucune étude comparative, en simple ou double insu, testant des isoflavones pures isolées du soja sur le plan des propriétés hormonales n’est actuellement disponible. L’apport de soja ou de ses dérivés par l’alimentation et la phytothérapie peut être à l’origine d’une surcharge en phytoestrogènes, ce qui pourrait donner à reconsidérer les effets d’une imprégnation oestrogénique par les phytoestrogènes à long terme.
Action hypocholestérolémiante
Les investigations dans ce domaine ont montré des résultats controversés. Une action hypocholestérolémiante de la fraction protéique des graines de soja est retrouvée dans la littérature. À partir de 24 essais cliniques, un effet, cliniquement significatif, des protéines de soja sur les taux sanguins de cholestérol total et de LDL-cholesterol a été décrit. Cet effet est d’autant plus prononcé que la cholestérolémie initiale est élevée (4) (5). Cet effet hypocholestérolémiant serait induit par les isoflavones contenus dans les protéines de soja. Certaines études décrivent une diminution, après une prise de 60 g/j de protéines de soja, de 9,6 % du cholestérol total chez des femmes en pré-ménopause sans symptômes alors que d’autres décrivent avec la même prise pendant 4 semaines chez des femmes en postménopause une augmentation de 14 %(6).
Action sur les mécanismes thrombotiques
En ce qui concerne les maladies cardiovasculaires, les isoflavones joueraient un rôle préventif. Les propriétés anti-oxydantes des isoflavones permettraient des effets cardioprotecteurs. Une étude dans l’athérosclérose a montré que la génisteine empêcherait la formation de la thrombine et l’activation plaquettaire in vitro en plus de son activité d’inhibition de la croissance cellulaire(7).
Action anticancéreuse
Les isoflavones inhibent des tyrosines-kinases qui joueraient un rôle dans les processus de transformation et de prolifération cellulaire. Ils induisent l’apoptose dans certaines situations et sur certaines lignées cellulaires comme la génisteine, mais à concentration très élevée(8). Des tentatives d’essais in vitro sur des lignées de cellules animales et humaines n’ont pas clairement prouvé d’effet antiprolifératif sur des cellules oestrogéno-dépendantes. Plusieurs études épidémiologiques ont été réalisées en Extrême-Orient et aux États-Unis, sans résultats permettant une conclusion univoque(9). Les données chez l’homme de l’action du soja contre le cancer de la prostate sont peu concluantes(10).
Action sur la densité osseuse
Des études chez les rongeurs ont décrit un effet protecteur des isoflavones en matière de perte osseuse(11). Chez la femme ménopausée, plusieurs études montrent une densification osseuse liée à la prise de soja. Potter et coll. ont montré qu’une prise de 6 mois de protéines de soja augmentait la densité osseuse chez des femmes en post-ménopause par rapport à un régime à base de caséine(7). Les effets protecteurs obtenus chez l’animal et des indicateurs relatifs à la perte osseuse permettent d’envisager une action des isoflavones dans l’ostéoporose, mais des études utilisant des traitements à long terme doivent être entreprises afin d’essayer de démontrer clairement ces résultats.
Action analgésique
Les effets analgésiques d’un régime à base de soja sur trois modèles animaux de douleur cancéreuse osseuse ont été étudiés. Les résultats montrent qu’un régime à base de soja pourrait avoir une action analgésique sur certaines formes d’hyperalgésie liées au cancer des os. Cependant, d’autres recherches sont nécessaires pour étoffer cette hypothèse(12).
Mécanismes d’interaction entre des produits à base de soja et les anticoagulants oraux
Apport de vitamine K
Les études démontrent qu’entre 20 à 25 % des patients sous AVK sont mal équilibrés du fait d’une observance insuffisante, d’interactions médicamenteuses, de pathologies intercurrentes ou d’apports alimentaires fluctuants en vitamine K. Les apports journaliers recommandés en vitamine K sont de 1 mg/kg/j. Des apports supérieurs ou égaux à 250 mg/j induisent une résistance relative aux AVK, avec la nécessité de posologies plus importantes, pour maintenir un INR thérapeutique. Il est recommandé, par conséquent, un apport constant, stabilisé en vitamine K minimal de 1 mg/kg/j ou de 110 mg/j et maximal de 250 mg/j(13).
Il existe deux types de vitamine K : la vitamine K1 (phylloquinone), présente dans les légumes feuilles (bette, épinard, chou frisé, salade), les herbes aromatiques, les légumes crucifères (brocoli, chou de Bruxelles), les huiles végétales (soja, colza, olive) et les produits préparés avec ces huiles; et la vitamine K2 (ménaquinone), présente dans la viande, les foies de ruminants, le beurre, les oeufs, les graines de soja fermenté (natto) et le fromage. Une étude chez six volontaires a évalué l’absorption des vitamines K1 et K2 en fonction des aliments ingérés. Les volontaires ont consommés 400 g d’épinard (3,5 mmol de vit. K1) et 200 g des graines de soja fermenté (3,1 mmol de vit. K2). La concentration sanguine retrouvée en vitamine K2 est 10 fois supérieure à celle en vitamine K1. La contribution de la vitamine K2 (ménaquinone) dans le rapport en vitamine K chez l’homme semble être surexprimée. Des recherches plus approfondies sur le rôle de la vitamine K2
dans l’interférence potentielle avec les médicaments anticoagulants doivent être envisagées.
L’effet antagoniste des graines de soja fermenté sur la warfarine est connu depuis 1978. Une des hypothèses de cet antagoniste est la production en grande quantité de vitamine K par les bacilles des graines de soja fermenté dans les intestins(14).
Modification de l’absorption ou du métabolisme de la warfarine
Des valeurs subthérapeutiques d’INR ont été observées chez un homme de 70 ans équilibré sous traitement par warfarine après l’ingestion de protéines de soja sous forme de lait de soja(15). Le patient était stabilisé (INR entre 2,3 et 2,5) avec 3 mg par jour de warfarine. Ce patient a commencé à boire 480 ml de lait de soja par jour pour traiter son hypertriglycéridémie. Après cinq jours, son INR était à 1,9. Après quatre semaines, son INR était à 1,6. Les valeurs subthérapeutiques d’INR n’ayant pu être expliquées par des facteurs connus pour réduire l’INR, le lait de soja a été arrêté. Durant les deux mois suivants, les valeurs d’INR sont revenues dans la fourchette thérapeutique visée (entre 2 et 3) sans changement à la dose de warfarine.
Dans notre organisme, il existe plusieurs systèmes de protection contre des substances exogènes : d’une part, les systèmes enzymatiques dégradant les toxiques et les médicaments dans le foie et l’intestin, comme les isoenzymes du cytochrome P450 ; d’autre part, les transporteurs de médicaments dans l’intestin et le foie, qui font que de nombreuses substances étrangères sont expulsées des cellules épithéliales de l’intestin dans la lumière intestinale ou des cellules hépatiques dans la bile. Ces substances sont alors éliminées dans les selles.
Le transporteur de médicaments le mieux documenté à ce jour est la glycoprotéine P (PGP), faisant partie de la superfamille des protéines vectrices ABC (ATP-Binding Cassette), qui transportent sous la dépendance de l’adénosine-triphosphate (ATP) plusieurs xénobiotiques, comme la cyclosporine A, la dexaméthasone, la digoxine, la doxorubicine, l’étoposide, l’ivermectine, l’ondansétron, le paclitaxel et la vinblastine(16). Les systèmes d’efflux et de transport de médicaments sont importants dans le métabolisme des médicaments parce qu’ils facilitent ou limitent l’absorption et l’élimination de médicaments.
La PGP est une protéine transmembranaire de 170 kDa, composée de 1 280 acides aminés. Sa structure est caractéristique des systèmes de transport ATP-dépendants : elle traverse douze fois la membrane, et ses deux régions situées à la face interne de la membrane portent des sites de liaison à l’ATP. Elle est présente dans les cellules intestinales (jéjunum, colon), dans celles des tubules rénaux et des canalicules biliaires, mais aussi de la barrière hématoencéphalique, où elle assure une fonction de détoxication. La PGP limite donc l’absorption intestinale des médicaments. En favorisant leur passage dans la lumière de l’intestin, elle induit leur élimination en les transportant dans la lumière des canaux biliaires et tubulaires. Ainsi, l’inhibition de la PGP facilite l’absorption et la distribution des médicaments et réduit leur élimination, contribuant à une élévation de leur concentration plasmatique. La ciclosporine, la quinidine, le vérapamil, l’amiodarone, les antifongiques azolés, les macrolides inhibent la PGP. À l’inverse, la rifampicine l’activerait. Les recherches se développent actuellement vers les nouveaux systèmes de captation des médicaments pour les fonctions intestinale et hépatique (systèmes OATP et isoformes), permettant une meilleure compréhension des facteurs pouvant agir sur l’absorption et l’élimination des médicaments(17) (18).
Les hypothèses discutées quant aux mécanismes de l’interaction dérivés de soja (lait de soja, Phytosoya® ou protéines de soja)/anticoagulants oraux reposent sur le fait que les isoflavones de soja, la génisteine et la daidzeine pourraient altérer l’absorption, le métabolisme et l’excrétion biliaire des AVK en agissant sur ses systèmes de transport (glycoprotéine P et OATP) ainsi que sur les isoenzymes du cytochrome P450. La génisteine et la daidzeine peuvent empêcher la glucuronidation. La génisteine a, en effet, inhibé les isoenzymes CYP1A2 et 2E1 chez l’animal et in vitro.
Les isoenzymes du cytochrome P450 métabolisant la fluindione ne sont actuellement pas connues. C’est pourquoi nous extrapolons à la fluindione les résultats observés avec la warfarine (effet classe). En ce qui concerne la warfarine (mélange racémique de R et de S énantiomères), AVK le plus étudié, le système d’isoenzyme du cytochrome P450 est connu pour être impliqué dans son métabolisme. La S-warfarine (approximativement 2 à 5 fois plus efficace que le R-énantiomère) en 7-S-hydroxy-warfarine est métabolisée principalement par le CYP2C9. La R-warfarine est métabolisée principalement par les isoenzymes CYP1A2 et 3A4 en alcools diastéréoisomériques, qui ont une certaine activité anticoagulante (inférieure à la S-warfarine). D’autres isoenzymes du cytochrome P450 impliquées dans le métabolisme de la warfarine incluent le 2C8, le 2C18 et le 2C19. Il existe une diversité de réponses à la warfarine à la fois dose dépendante et patient spécifique en ce qui concerne l’INR.
Il n’existe pas actuellement de données sur les effets du système d’efflux de la PGP et du transporteur OATP sur l’absorption, le métabolisme et l’élimination de la warfarine. Des médicaments inducteurs et inhibiteurs enzymatiques du cytochrome P450 agissent de façon similaire sur la PGP, pouvant entraîner une confusion dans l’interprétation des interactions. Les produits alimentaires à base de soja contiennent des quantités variables d’isoflavones, et il est difficile de déterminer si une interaction aliment/médicament impliquant les protéines de soja est dose dépendante ou influencée par le rapport entre la génisteine et la daidzeine contenues dans un produit à base de soja.
Conclusion
Le retour en 15 jours de l’INR de notre patiente dans la fourchette thérapeutique souhaitée, par la seule modification de la posologie de la fluindione (pas d’autres facteurs extérieurs), renforce l’imputabilité des isoflavones, la génisteine et la daidzeine, contenus en concentrations fixes dans la spécialité Phytosoya®. Lors d’une variation d’INR chez un patient sous anticoagulant, la question d’une consommation de soja et/ou de produits dérivés du soja devrait donc être envisagée. Une information auprès des praticiens et des patients est nécessaire, en insistant sur les risques de l’automédication (y compris par la phytothérapie) et les interactions possibles entre les AVK et les aliments et/ou les boissons.
|

